Na jednym z wykładów, gdy jako studenci narzekaliśmy na to, że rozwiązanie równania Schrödingera dla atomu wodoru jest trudne a przynajmniej marudne, wykładowca prof. Pękalski uśmiechnął się i jako przykład do naśladowania podał nam studentów chemii. Ci z kwantowym atomem wodoru zaznajomieni są za pan brat. Postać funkcji falowych, to podstawa określania własności orbitali, więc nie mają kłopotów z wyjaśnieniem dlaczego i skąd wzięła się taka a nie inna liczba kwantowa… Wyszło na to, ze chemicy znają fizykę atomową lepiej od fizyków. Nie pocieszyło nas to zbytnio, ale utwierdziło w przekonaniu, że do roboty wziąć się trzeba.
Sytuacja ta przypomniała mi się, kiedy kilkanaście dni temu, dość przypadkowo zetknąłem się z książką R. T. Morrisona i R. N. Boyda „Chemia organiczna”. To zaawansowany, przynajmniej dla mnie, podręcznik z chemii, choć muszę przyznać, że jak się zna podstawy mechaniki kwantowej, to przysiadając fałdy, można dość sprawnie posiąść zawartą tam wiedzę. Z książki tej, dowiedziałem się na przykład, że chemicy oprócz grzebania w powłokach elektronowych skutecznie wykorzystują też kwantowe własności jąder atomowych – NMR (Nuclear magnetic resonance) czyli jądrowy rezonans magnetyczny jest dla nich bardzo pożytecznym narzędziem.
Dodam: NMR jest niemalże klinicznym przykładem przejawiania się własności kwantowych.
Różnica energii
Czym jest NMR? W największym skrócie to obserwacja widma jądra atomowego, umieszczonego z wewnętrznym polu magnetycznym. Analogicznie obserwuje się widma atomowe, czyli promieniowanie wynikające z przeskoków na powłokach elektronowych. Kiedy wsadzimy atomy w pole magnetyczne, to emitowane przez nie widmo nieco się zmieni. Mając w pamięci tę analogię, zobaczmy jak to wygląda dla jąder.
Energie jakie mają nukleony w jądrze są zdecydowanie większe od tych elektronowych – nie dziwota, wszak przeskokowi protonu czy neutronu z poziomu wyższego na niższy odpowiada wysokoenergetyczny kwant promieniowania gamma. Ale jądro może promieniować również w zdecydowanie niższych zakresach energetycznych. Dzieje się tak wtedy, gdy nukleony oddziałują z zewnętrznym polem magnetycznym. Energia będzie różna w zależności od ustawienia spinu jądra (a co za tym idzie momentu magnetycznego) względem pola.
To co jest mierzone, to różnica energii pomiędzy ustawieniem spinu „zgodnie z polem magnetycznym” a „przeciwnie do pola”[1]. Dlaczego pomiar ujawnia tylko takie stany? Mechanika kwantowa nie ma problemu z wyjaśnieniem: Wychodzi od tego, jakie są stany, gdzie energia jest ściśle określona – tzw. stany własne energii – i wie, że różnicę tych energii da się obserwować w postaci promieniowania e-m. Oczywiście jest ona trochę bezradna, gdy spytać ją o formalne aspekty „skoku kwantowego”, ale zawsze udaje jej się znaleźć jakieś wytłumaczenie, co ważne: zgodne z doświadczeniem.
No to zobaczmy jak wygląda energia dipola w polu magnetycznym. W mechanice kwantowej wielkościom fizycznym (obserwablom) odpowiadają operatory. W przypadku spinu stan, to wektor zespolony o dwóch współrzędnych, a operator to macierz 2×2. Sztuka polega na takim dobraniu układu współrzędnych w przestrzeni stanów, by operator energii miał niezerowe elementy tylko na przekątnej. Uczenie nazywa się to rozwiązywaniem stacjonarnego równania Schrödingera, ale w przypadku macierzy 2×2 jest dość proste i wynik (opuszczę tu już wyprowadzenia) jest następujący:

Do zapisania operatora energii, użyłem literki E, choć zwykle pisze się literkę H – to po to, żeby nie pomylić energii z polem magnetycznym, którego wektor zapisuje jako H (albo B, jak we wzorze wyżej, gdy chodzi o wektor indukcji pola).
Czyli przeskok ze stanu wzbudzonego „pole dipola i pola zewnętrznego mają ten sam kierunek” do stanu podstawowego „oba pola są zwrócone przeciwnie” spowoduje emisję fotonu o częstości kołowej ω i energii ΔE:

Powyższy wzór odpowiada jądru atomu wodoru, wtedy współczynnik g=2,675. Można jednak stosować tę metodę również dla innych jąder o niezerowym spinie, tyle że obliczenia będą skomplikowańsze.
Słowo o obserwacji: Jest kilka metod „zmuszania” jąder do promieniowania: Wybiera się jakąś wartość pola magnetycznego i „naświetla” próbkę promieniowaniem radiowym o zmiennej częstotliwości. Kiedy częstotliwość odpowiada energii przeskoku, następuje absorpcja, a potem emisja. Zdaje się wygodniejsza jest druga droga: Wprowadza się cząsteczki (czyli ich jądra również) w pole e-m o stałej częstotliwości a zmienia wielkość zewnętrznego pola magnetycznego. To nie jedyne sposoby – istnieją dokładniejsze, dające wyniki zdecydowanie szybciej – są to tzw. metody impulsowe. SNAFU wspomniał na przykład o echu spinowym, wciąż się zastanawiam jak je opisać, by nie wyszło zbyt hermetycznie – jak mi się uda, to będzie to temat następnej notki.
Zajrzyjmy jednak w końcu do książki, żeby dowiedzieć się do czego chemikom potrzebny jest ten rezonans.
Przesunięcie chemiczne
We wspomnianej książce zjawisko NMR służy głównie jako narzędzie do badania atomów wodoru[2], a dokładniej protonów, bo wodór to proton i elektron. Osobom choć trochę zorientowanym w chemii nie trzeba przypominać, że czasami trudno powiedzieć do jakiego jądra należy elektron tworzący dane wiązanie. Od siebie dodam, że tym którzy nie godzą się z kwantówką, również trudno będzie pogodzić się z konfiguracją elektronową co ciekawszych związków.
Ale wróćmy do NMR i protonów. We wzorze powyżej mamy pole magnetyczne, ale proton zanurzony jest nie tylko w zewnętrzne pole magnetyczne, ale również oddziałuje z elektronami tworzącymi wiązania. Dość obrazowo można powiedzieć, że elektrony te będą ekranować zewnętrzne pole i przez to energia oddziaływania pola z dipolem będzie mniejsza, niż obliczona we wzorze zapisanym powyżej. Różnicę tę nazywa się przesunięciem chemicznym. Nie jest ona wielka – mniej więcej milion razy mniejsza od wartości zmierzonej dla „gołego” protonu. Jedna milionowa to inaczej ppm[3] – to zwykle stosowana jednostka przy pomiarach tego odchylenia.
I teraz to, co dla chemików jest najważniejsze: dla każdego typu „dowiązania” wodoru do reszty cząsteczki, istnieje charakterystyczna konfiguracja elektronowa; każda zmienia energię protonu o nieco inną wartość. Protony będące w tej samej sytuacji, mające takie samo otoczenie elektronowe, chemicy nazywają równocennymi – to te, dla których przesunięcie jest jednakowe.
Każdy sposób „użycia” atomu wodoru w danym związku będzie skutkował innym charakterystycznym przesunięciem chemicznym. Zacytuję z opisywanej książki kilka przykładów dla węglowodorów w tabelce poniżej:
| rodzaj protonu | wzór str. | przesunięcie [ppm] |
|---|---|---|
| pierwszorzędowy | 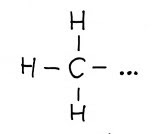 |
0,2 |
| drugorzędowy |  |
0,9 |
| trzeciorzędowy | 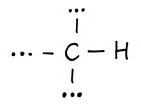 |
1,3 |
| i wiele innych rodzajów układów z dołączonym H… |
… | …a każdy z nich ma inną wartość przesunięcia |
Wielkość względna odczytanych sygnałów pozwala na procentowe określenie ilości wodorów danego „rodzaju”. To ważne, kiedy mamy tylko informację np. o całkowitej ilości atomów węgla i wodoru, nie wiedząc jak są względem siebie poukładane.
Rozszczepienie poziomów
Często rejestrowane widma, mają dość ciekawą strukturę – jak się przyjrzeć dokładniej, to niektóre linie widmowe składają się z kilku „podlinii”. Skąd się to bierze? W poprzednim punkcie analizowaliśmy wpływ powłok elektronowych, teraz przyszła pora na uwzględnienie wpływu znajdujących się w pobliżu protonów. Energia oddziaływania zależy od ustawienia spinu sąsiednich protonów i nazywa się to sprzężenie spin-spin. Znów zamiast wypisywać wzory według których można sobie to sprzężenie policzyć, napiszę tylko, że naszemu protonowi będzie wygodnie, jeśli sąsiednie spiny będą zwrócone przeciwnie, a układ zgodnych spinów kosztować będzie więcej energii.
W tym miejscu zacytuję obrazkowo książkę z chemii. Obrazek dotyczy sytuacji:

a dokładniej pokazuje widmo wynikające z „przeskoków” wodoru, który został „wytłuszczony” na obrazku. Zamiast szczegółowego opisu, co i dlaczego, przygotowałem pokolorowany rysunek, żeby czytelnik sam odszukał sobie, które linie odpowiadają jakim przeskokom, a przy okazji odpowiedział sobie, dlaczego jedne linie są bardziej intensywne od innych.
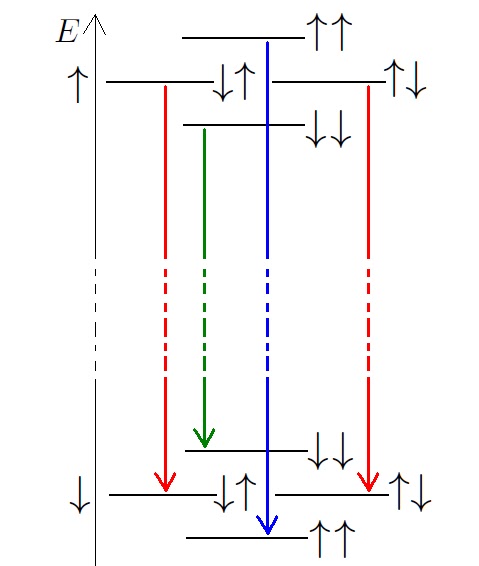
Mam nadzieję, że czytelnicy domyślą się, że obrazek nie zachowuje skali pionowej – gdyby zmiany poziomów energetycznych, wynikające z oddziaływania spin-spin, miały być przedstawione realistycznie obrazek musiałby być straasznie wysoki. Strzałki obok poziomów, pokazują orientację sąsiednich protonów, mających wpływ na promieniujący proton.
Wstęp wstępem
W tym miejscu chciałbym przeprosić chemików, że tylko liznąłem tematu NMR w chemii, koncentrując się na szczegółach mogących zaciekawić fizyka. W dodatku opisałem tylko te najprostsze, stosowane chwyty. Bo oczywiście im dokładniej zaglądniemy w owe widma, tym opis staje się skomplikowańszy, ale tym więcej użytecznych informacji można wyciągnąć. Na koniec oddam głos autorom książki: Otrzymuje się widmo o dużej liczbie sygnałów, których względne położenie, odzwierciedlające różnice w położeniu protonów, dostarczają wręcz niewiarygodnie szczegółowych informacji o strukturze cząstki.
[1] Skoro wspomniałem analogii ze promieniującym atomem – NMR jest w pewnym sensie odpowiednikiem sławnego promieniowanie 21 cm obserwowanego dla atomu wodoru.
[2] Skoncentrowanie się przeze mnie i autorów na wodorach ma tę zaletę, że to prosty układ, bo jednocząstkowy – nie musimy zastanawiać się nad strukturą wewnętrzną jądra. Jedną z ważniejszych rzeczy jakie bada chemia organiczna są przecież wzajemne wiązania między wodorem a węglem.
[3] Czyta się to zwykle „pi-pi-em” i jest szeroko stosowane do określania wielkości, dla których procenty i promile są zbyt wielkie. Na przykład w przypadku jakichś zabójczych trucizn. Słyszy się czasami: „Tyle, to a tyle pipiemów czegośtam w powietrzu powoduje zatrucie”.







Komentarze
Pokaż komentarze (30)