Jakie byłoby prawdopodobieństwo znalezienia przez kogoś bezuzytecznych, bo źle wypełnionych kuponów totolotka? Jakie jest prawdopodobieństwo znalezienia kuponu z prawidłowo skreślonymi cyframi (z głowną wygraną) każdego dnia tysiąc razy z rzędu?
Sir Fred Hoyle, kierujac się wiedzą biochemiczną postawil optymistyczne założenia. Ze zbioru białek u ameby wyodrębnił odpowiedzialne za metabolizm - wlaściwe też bakteriom czy ludziom. Tych enzymów bylo kilkadziesiąt. Profesor sir Fred Hoyle wiedział, że białka żeby spełniać swoją rolę muszą występować w wielu kopiach, co pozwala osiągnać właściwe stężenia w cytoplaźmie.
Należy też zaznaczyć, że Fred Hoyle nie obliczał prawdopodobieństwa powstania całej żywej komórki, tylko zestawu białek, które są odpowiedzialne głównie za metabolizm!
EWOLUCJA CHEMICZNA
https://www.salon24.pl/u/slawekp7/1318585,rozte-typy-doborow-naturalnych-autentyczne-i-hipotetyczne

Jakie byłoby prawdopodobieństwo znalezienia przez kogoś bezuzytecznych, bo źle wypełnionych kuponów totolotka? Jakie jest prawdopodobieństwo znalezienia kuponu z prawidłowo skreślonymi cyframi (z głowną wygraną) każdego dnia tysiąc razy z rzędu?
Sir Fred Hoyle, kierujac się wiedzą biochemiczną postawil optymistyczne założenia. Ze zbioru białek u ameby wyodrębnił odpowiedzialne za metabolizm - wlaściwe też bakteriom czy ludziom. Tych enzymów bylo kilkadziesiąt. Profesor sir Fred Hoyle wiedział, że białka żeby spełniać swoją rolę muszą występować w wielu kopiach, co pozwala osiągnać właściwe stężenia w cytoplaźmie.
Należy też zaznaczyć, że Fred Hoyle nie obliczał prawdopodobieństwa powstania całej żywej komórki, ty9lko zestawu białek, które są odpowiedzialne głównie za metabolizm!


Hoyle nie wyliczał prawdopodobieństwa, w jaki sposób konkretne aminokwasy odnajdą sie w racemacie bulionu pierwotnego i przypadkowo połączą się w funkcjonalne polipeptydy - w tym samym miejscu i czasie.
Nie obliczał prawdopodobieństwa powstania materiału genetycznego, który mógłby kodować białka oraz całej maszynerii replikującej DNA i transkrypcyjno-translacyjnej. Błony komórkowej, która by to wszystko otaczała oddzielając od zewnętrznego środowiska, co umożliwia życie. W przeciwnym razie białka rozpłynęłyby się w róznych kierunkach oceanu. Fred Hoyle skoncentrował się na samych sekwencjach polipeptydów i obliczał możliwość prawidłowego ułożenia się aminokwasów we właściwej kolejności.


Fred Hoyle po latach badań nad pochodzeniem życia stwierdził:
https://tiny.pl/c5v9m
„Wielkim problemem biologii ewolucyjnej nie jest sam oczywisty fakt, że białko to łańcuch aminokwasów połączonych ze sobą w określony sposób, lecz okoliczność, że ich kolejność nadaje temu łańcuchowi szczególne właściwości.
Gdyby aminokwasy zostały połączone przypadkowo, rezultatem byłaby ogromna liczba kombinacji nieprzydatnych żywej komórce. Kiedy się rozważy, że typowy enzym we współczesnych komórkach jest łańcuchem złożonym z jakichś 200-300 aminokwasów i że dla każdego z tych ogniw istnieje 20 możliwości, to łatwo zauważyć, iż liczba bezużytecznych kombinacji jest kolosalna. Większa od liczby atomów we wszystkich galaktykach dostrzegalnych przez największe teleskopy. Tak wygląda sytuacja w wypadku jednego enzymu, a przecież niezbędna ich liczba w minimalnej komórce wynosi przeszło 2000 i służą bardzo różnym celom. Jakim więc sposobem wszystkie one zaistniały?”

https://www.salon24.pl/u/slawekp7/1318689,wybitny-biolog-profesor-stanislaw-mariusz-karpinski-o-ewolucji-chemicznej-abiogenezie-i-ewolucji-biologicznej


https://www.simonandschuster.com/books/Evolution-from-Space/Fred-Hoyle/9780671492632


Komórka bakteryjna, to jeden worek na wszystko. Dajmy na to, że jeden z tych kilkudziesięciu enzymów rozczepia jakich substrat do dwóch produktów przyswajalnych przez bakterie, jako pożywienie.
Jeden enzym nie poradziłby sobie z tym zadaniem. Istnieją małe szanse, żeby trafił na jedną z tysięcy cząsteczek substratu, jakie pochłonęła bakteria! Nawet gdyby jeden enzym przypadkowo trafił na kilkadziesiąt cząsteczek substratu, to zaden z tego pożytek. Bakteria umrze z glodu. Nikt się nie naje kilkoma okruchami chleba!
Sprawa wygląda inaczej, gdy na cząsteczki substratu poluje 100, 200 lub 300 enzymów w cytoplaźmie bakteryjnej Dlatego Fred Hoyle ustalił minimalną liczbę białek niezbędnych do życia na 2000!
https://slawekp7.wordpress.com/2014/12/26/genom-minimalny/

https://slawekp7.wordpress.com/2021/08/09/abiogeneza-najpierw-rna-najpierw-metabolizm-czy-najpierw-bialka/





Fred Hoyle założył, że na początku ewolucji chemicznej białka musiały być krótsze. Więc przyciął, że te kilkadziesiąt polipeptydów składało się mniej wiecej ze 100 aminokwasów każdy.
Kilkadziesiąt rodzajów enzymów - każdy złożony ze 100 aminokwasów. Przy czym każdy z tych proto-enzymów występował w wielu kopiach. W sumie było ich 2000. Należy zaznaczyć, że przeciętna długość współczesnych pilipeptydów, to 200 - 300 aminokwasów. Wprawdzie występują długie peptydy, ale też krótkie polipeptydy.
https://pl.m.wikipedia.org/wiki/Peptydy
https://pl.m.wikipedia.org/wiki/Bia%C5%82ka
Białka zbudowane z mniej niż 50 aminokwasów tracą zdolność do pełnienia funkcji enzymów, czy białek strukturalnych. Nie są w stanie zachować użytecznych konformacji.
W przyrodzie występuje ponad 300 różnych aminokwasów, jednak do budowy ludzkich białek jest wykorzystywanych tylko około 20 z nich. W tej grupie znajdują się zarówno aminokwasy endogenne, czyli takie, które organizm jest w stanie wytworzyć samodzielnie, jak i aminokwasy egzogenne, które muszą być dostarczane drogą pokarmową.

https://www.edukator.pl/resources/page/kodgenetyczny/2352
https://pl.m.wikipedia.org/wiki/Aminokwasy_bia%C5%82kowe
https://pl.m.wikipedia.org/wiki/Aminokwasy_egzogenne
https://pl.m.wikipedia.org/wiki/Aminokwasy_endogenne
https://pl.m.wikipedia.org/wiki/Aminokwasy_niebia%C5%82kow
Kiedy polipeptyd zakodowany jest w łańcuchu DNA w formie genu, to różne obszary genu tolerują mutacje tak zwane neutralne - bez wpływu na strukturę, czy funkcje białka. Inne obszary nie tolerują żadnej mutacji, która zmieni informację w kodonie, co skutkuje zamianą jednego aminokwasu na inny.
Nowy aminokwas ma inne właściwości biochemiczne i nie może tak oddziaływać z innymi, jak ten w miejsce którego został wstawiony. Np. jeden może być hydrofilowy inny hydrofobowy. Zamiana taka w wyniku mutacji w DNA może mieć subletalne lub letalne skutki!
Białko nie zwinie się na tym odcinku prawidłowo, co zakłóci zwijanie i fałdowanie w innych regionach. Bialko może przyjąć nieprawidłowy kształt (konformację), co uniemożliwi spotkanie się różnych konkretnych aminokwasów tworzących kieszen na substrat, który musi pasować do niego, jak klucz do zamka - centrum aktywne.
Zmutowane białko może stracić stabilność, bo w białku z zakłóconym procesem zwijania (z rozchwianą konformacją) nie wytworzą się spinające je i stabilizujące mostki dwusiarczkowe. Mutacja może też zmienić aminokwas w samym centrum aktywnym. Wówczas białko będzie prawidłowo zwinięte, ale niezdolne do przekształcania substratu w produkt.
https://slawekp7.wordpress.com/2019/05/19/oszalamiajaca-zlozonosc-wynikajaca-z-prostoty-wszystko-co-zyje-sklada-sie-z-mikroskopijnych-lancuchow/





https://www.researchgate.net/figure/Variety-of-protein-structures-Examples-of-different-types-of-proteins-are-shown-to_fig3_269806015

Takie mogą być skutki pojedynczej mutacji, która doprowadziła do zmiany JEDNEGO rodzaju aminokwasu na INNY w liczącym 300 aminokwasów polipeptydzie. Takich konserwatywnych miejsc, które nie tolerują żadnych zmian może być w białku złożonym z 300 aminokwasow 150, albo nawet więcej! Zatem geny, jak i ich produkty białka tolerują wiele zmian tego rodzaju. Jeżeli zdarzy się mutacja uszkadząjaca funkcje białka zostaje ono oznaczone i poddane recyklingowi w proteasomie.
Podczas zakładanej ewolucji chemicznej (prebiotycznej) wszystkie konserwatywne aminokwasy musiałyby się losowo ułożyć w konkretnych miejscach wydłużajacego się polipeptydu - złożonego (jak optymistycznie założył Fred Hoyle) ze 100 aminokwasów. Gdyby jeden taki konserwatywny aminokwas w funkcjonalnym białku w powstałej protokomórce - np. tworzący centrum aktywne enzymu - był oddzielony od kolejnego konserwatywnego dziesięcioma aminokwasami, które dopuszczają dowolną ilość podstawień, to podczas losowej ewolucji chemicznej aminokwasy musiałoby się dokładnie tak samo przyczepić do spontanicznie wydłużającego się polipeptydu!
Właściwe funkcjonowanie białka jest zależne od właściwości biochemicznych danego rodzaju aminokwasów, jak i ich położenia strukturalnego. Zatem obszary białka, które tolerują podmiany aminokwasów w wyniku mutacji DNA nie zmniejszają prawdopodobieństwa ich spontanicznej syntezy.



Różne podstawione aminokwasy posiadają takie same właściwości, co umożliwia zwijanie się tych domen w konkretne struktury: helisy czy charmonijki. Zdarza się, że takie miejsce toleruje tylko dwa rodzaje aminokwasów. Mutacja powodująca podmiane na inny również może zdestabilizować funkcję białka. Tolerowanie tych podstawień jest mechanizmem ograniczającym skutki szkodliwych (subletalnych), czy letalnych mutacji. Delecja, mutacja powstajaca w wyniku utraty fragmentu genu, po usunieciu obszaru tolerujacego podstawanie aminokwasów zniszczy białko!

Gen składa sie z sekwencji nukleotydow zwanej PROMOTOREM inicjującym transkrypcję - Z WEWNĘTRZNEJ RAMKI ODCZYTU, gdzie zakodowane jest białko. Następnie z sekwencji TERMINUJACEJ TRANSKRYPCJĘ. Wystarczy usunać jeden nukleotyd z wewnętrznej ramki odczytu i cały zapis straci pierwotny sens. WRO (Wewnętrzna Ramka Odczytu) inaczej sekwencja kodująca-strukturalna składa się z TRIPLETÓW, to znaczy z KODONÓW. Trójek nukleotydów o konkretnych sekwencjach:
https://pl.m.wikipedia.org/wiki/Geny_nak%C5%82adaj%C4%85ce_si%C4%99
Geny nakładające się – geny zakodowane na tym samym odcinku nici kwasu nukleinowego i odczytywane dzięki wykorzystaniu różnych ramek odczytu.
https://www.researchgate.net/figure/Different-types-of-overlapping-genes-a-Some-examples-of-different-strand-overlapping_fig2_344900446


TTA TTC TTG T.... i tak dalej. Każda taka trójka koduje jakis aminokwas, lub kilka. Zależy to od rodzaju kodonu. Usuńmy teraz dowolną literkę z tego ciągu trzech kodonów. Usuwam pierwszą zastępując: D TA TTC TTG T....No i wszystko sie poprzestawiało! D TAT CTC TGT...
W wodzie„ z której głównie składa się cytoplazma są rozpuszczone białka (zachowują odrębność nie sklejają się ze sobą - nie agregują), substraty i inne substancje (np. kofaktory). Jeżeli aminokwasy neutralne czy funkcjonalne-konserwatywne są hydrofobowe, to podczas zwijania się polipeptydu w białko woda je odpycha i chowają się do wewnątrz białka, które po zwinięciu zaczyna tworzyc bryłę o konkretnej przydatnosci. Jeżeli aminokwasy są hydrofilowe pozostają na zewnątrz. cząsteczki białka co umożliwia rozpuszczanie białek w wodzie Zapobiega zlepianiu, tworzeniu letalnych (smiertelnych) dla komorki agregatów. Właściwa sekwencja i rodzaj aminokwasów zawsze przekładają się na prawidłowe funkcjonowanie białek!



 9
9



EWOLUCJA BIOLOGICZNA
https://slideplayer.com/amp/9748396/

Michael Behe to jeden z najlepszych biologów teoretycznych [ewolucyjnych] w naszych czasach. To wytrawny znawca ewolucjonizmu molekularnego, specjalista od struktury białek i prawdziwy naukowiec. Np. tutaj jest jego rewelacyjna praca z dziedziny biologii ewolucyjnej opublikowana w porządnej literaturze naukowej. Dotyczy ona możliwości ewolucji białek w wyniku doboru kumulatywnego:
https://www.salon24.pl/u/slawekp7/1318585,rozte-typy-doborow-naturalnych-autentyczne-i-hipotetyczne

https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2286568/
„Uważa się, że duplikacja genów jest głównym źródłem innowacji ewolucyjnych, ponieważ umożliwia jednej kopii genu mutację i eksplorację przestrzeni genetycznej, podczas gdy druga kopia nadal spełnia pierwotną funkcję.
Modele tego procesu często domyślnie zakładają, że pojedyncza mutacja w zduplikowanym genie może nadać nową wybieralną właściwość. Jednak niektóre cechy białek, takie jak wiązania dwusiarczkowe lub miejsca wiązania ligandów, wymagają udziału dwóch lub więcej reszt aminokwasowych, co może wymagać kilku mutacji. Tutaj modelujemy ewolucję takich cech białek za pomocą tego, co uważamy za najprostszą koncepcyjnie drogę - mutację punktową w zduplikowanych genach.
Pokazujemy, że dla bardzo dużych populacji N, gdzie w stanie ustalonym przy braku selekcji można oczekiwać, że populacja będzie zawierać jeden lub więcej zduplikowanych alleli kodujących użyteczną cechę, czas do utrwalenia się jej w populacji oscyluje w pobliżu odwrotności punktu współczynnika mutacji i zmienia się powoli wraz z λ^th z 1/N, gdzie λ to liczba pozycji nukleotydów, które muszą zostać zmutowane, aby wytworzyć daną cechę.
Przy mniejszych populacjach czas do utrwalenia zmienia się liniowo z 1/N i przekracza odwrotność częstości mutacji punktowych. Dochodzimy do wniosku, że ogólnie rzecz biorąc, aby określić w 10^8 pokoleniach, wytwarzanie nowych cech białek, które wymagają udziału dwóch lub więcej reszt aminokwasowych po prostu w wyniku wielokrotnych (mnogich, powstałych równocześnie) mutacji punktowych w zduplikowanych genach, wymagałoby populacji nie mniejszej niż 10^9.”

PROBLEM MNOGICH (WIELOKROTNYCH, POWSTAŁYCH RÓWNOCZEŚNIE) LOSOWYCH MUTACJI

Podczas zakładanej ewolucji setek tysięcy różnych rodzajów białek na drodze duplikacji genów napotykamy podobną przeszkodę, co podczas opisanej wyżej ewolucji chemicznej. Neodarwiniści zakładają, że po duplikacji genu stopniowo, w wyniku kolejnych mutacji punktowych kopia zduplikowanego genu nabierała nowych funkcji.
Nawet gdyby mutacje te zachodziły w odpowiedniej kolejności, to białko - forma przejsciowa - musiałoby pełnić użyteczne funkcje. Być dostrzegalne przez dobór naturalny i dawać przewagę selekcyjną dając lepsze usprawnienie. W przeciwnym razie mutacja nie zostalaby rozpowszechniona w populacji na zasadzie selekcyjnego wymiatania. Tym samym nie zachodziłby dobór kumulatywny. Problem w tym, że białka nie mogły ewoluować stopniowo. W tym przypadku obowiązuje powszechnie występujaca zasada w bioligii molekularnej: WSZYSTKO ALBO NIC!
Wyobraź sobie, że do powstania jakieś niezbędnej korzystnej funkcji potrzebne są aż 4 mutacje: A, B, C , D. Że dopiero zestaw A, B, C ,D może dać korzyść selekcyjną (dostosowanie). Jaka więc korzyść z pojedynczych mutacji: A, B , C czy D, skoro żadna z nich z osobna nie daje żadnej przewagi selekcyjnej? Każda z osobna jest neutralna, bezużyteczna? W tym przypadku, żeby cecha określana przez mutacje: A, B, C, D mogła dać przewagę selekcyjną, to te 4 [kompletny zestaw] mutacje musiałyby nastąpić za jednym zamachem.
Jeżeli każda z tych 4 mutacji z osobna nie da przewagi selekcyjnej, to taka ewolucja po prostu nie ma szans nastąpić, ponieważ wtedy nie zadziała dobór kumulatywny. Istnieje wiele cech, których funkcję określają nierozerwalne zestawy konkretnie ulokowanych w genach nukleotydów.
Jeżeli mutacja wprowadzi zmiany w takich konserwatywnych sekwencjach gen przestaje spełniać swoje funkcje i organizm ginie [efekt letalny]. Wiele enzymów, czy białek strukturalnych, posiadają takie konserwatywne domeny (centra aktywne) i jakiekolwiek zaburzenia paraliżują ich funkcję. W podobny sposób zachowuje się enzym zatruty jakimś antybiotykiem. Kontakt z toksyną powoduje, że jego centrum aktywne traci swoją funkcję i przestaje pasować, jak klucz do zamka do konkretnego substratu.
https://www.salon24.pl/u/slawekp7/1328264,wyprawa-do-wnetrza-zywej-komorki-znakomity-film
Jeżeli nie byłoby kompletu potrzebnych mutacji za jednym razem, tylko powstawałyby stopniowo, to białko zwinęłoby się do pewnego momentu i ewolucja utyka w martwym punkcie. Tak też się dzieje w komórce. Zmutowane białka nie zwijają się prawidłowo i dlatego przestają być chronione przez inne białka, zwane chaperonami, ponieważ nie mają się jak przyczepić do źle sfałdowanego białka. Wówczas specjalny białko zwane ubikwityną naznacza mutanta do kasacji. Następnie zostaje ono poddane recyklingowi, polegającemu na zmieleniu na poszczególne aminokwasy w specjalnej maszynie zwanej proteasomem.
https://genetyka.bio/bialka-nasza-prywatna-armia-maszyn/

https://www.discovery.org/p/gauger/

”Dr Ann Gauger uzyskała tytuł licencjata na MIT i doktorat. z Wydziału Zoologii Uniwersytetu Waszyngtońskiego. Odbyła staż podoktorski na Uniwersytecie Harvarda, gdzie zajmowała się molekularną kinezyną motoryczną:
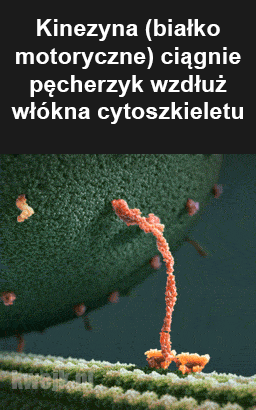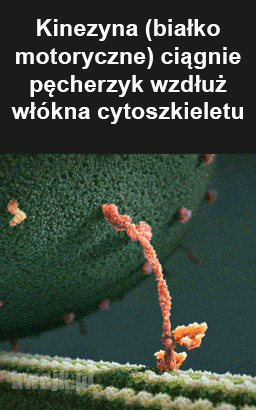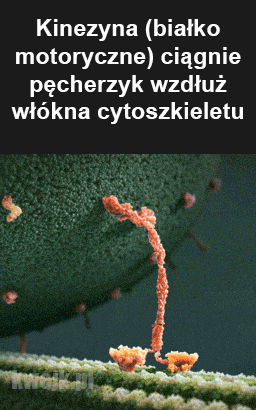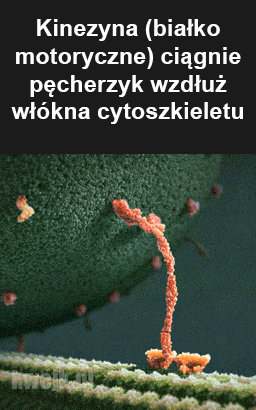
Jej badania w Instytucie Biologicznym skupiały się na dwóch obszarach: granicach neodarwinizmu jako mechanizmu zmian na poziomie białek. Jest redaktorem czasopisma BIO-Complexity, a jej prace naukowe publikowano w Nature, Development, Journal of Biological Chemistry, Genetic Registration of Development, In Vitro, In Vitro Cell and Developmental Biology, BIO-Complexity i Biological Informacje: Nowe perspektywy. Jest współautorką książki Science and Human Origins oraz wystąpiła w filmach dokumentalnych Metamorphosis, Flight i The War on Humans. Jej posty internetowe pojawiają się regularnie w Evolution News and Views, pisze także do innych publikacji internetowych i drukowanych.”
https://evolutionnews.org/2013/08/protein_evoluti/
„Białka występują w wielu kształtach i rozmiarach, jak widać na powyższej ilustracji zaczerpniętej z artykułu Douga Axe’a „The Case Against a Darwinian Origin of Protein Folds”. Niektóre mogą pełnić swoje funkcje jako pojedyncza złożona „domena”, spójna, stabilnie zwinięta jednostka struktury białka. Inne składają się z wielu połączonych domen lub nawet oddzielnych złożonych łańcuchów, które muszą się połączyć, tworząc jednostkę funkcjonalną przydatną dla komórki.
https://slawekp7.wordpress.com/2019/02/02/skad-sie-wzial-transport-pecherzykowy-w-chloroplastach-niektorych-roslin-skoro-nie-ma-go-u-bakterii-i-nie-bylo-u-wspolnego-przodka-wszystkich-glonow-i-roslin/
Sposób, w jaki białka udaje się złożyć do prawidłowego kształtu, jest obszarem aktywnych badań, o którym ostatnio dyskutowali inni.
http://eprints.ibb.waw.pl/374/
https://www.hpcwire.com/off-the-wire/summit-uncovers-details-of-molecular-ferris-wheels-inside-cell-structures/

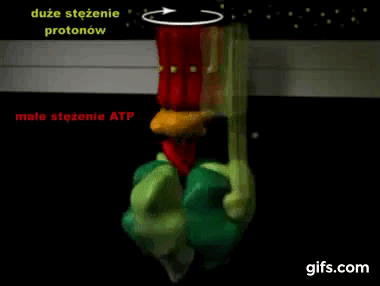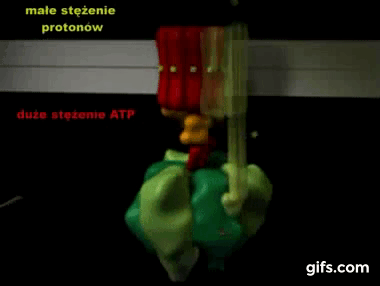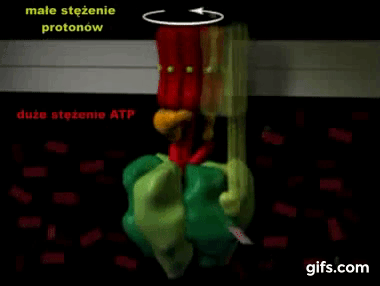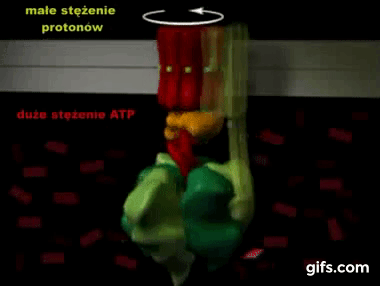

Silnik krokowy, silnik skokowy – silnik elektryczny, w którym impulsowe zasilanie prądem elektrycznym powoduje, że jego wirnik nie obraca się ruchem ciągłym, lecz wykonuje za każdym razem ruch obrotowy o ściśle ustalony kąt-za wikipedią
https://slawekp7.wordpress.com/?s=Kooptacji&submit=Szukaj

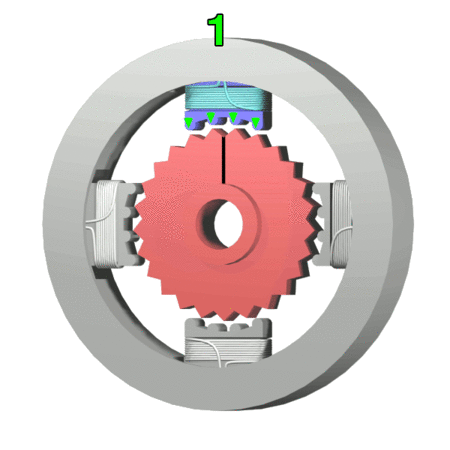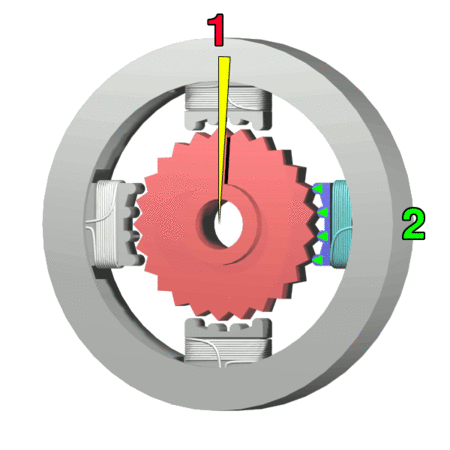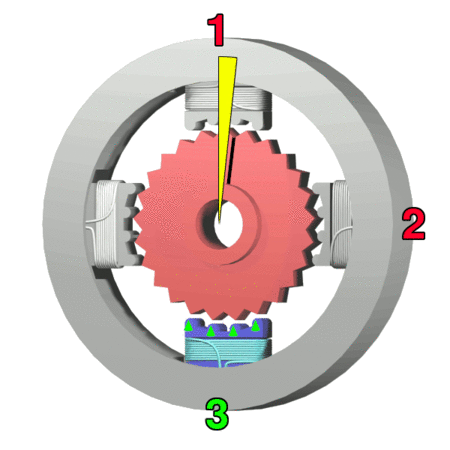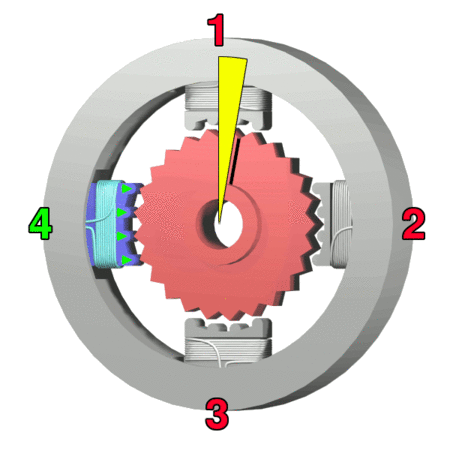
https://makeagif.com/amp/PSzmkl


http://www.ks.uiuc.edu/Research/namd/spotlight/

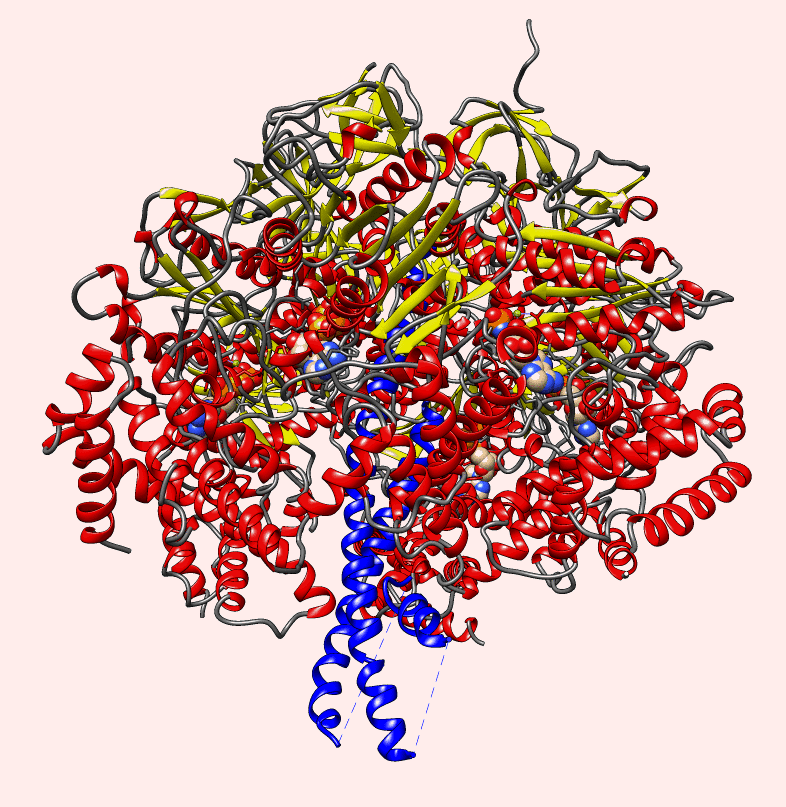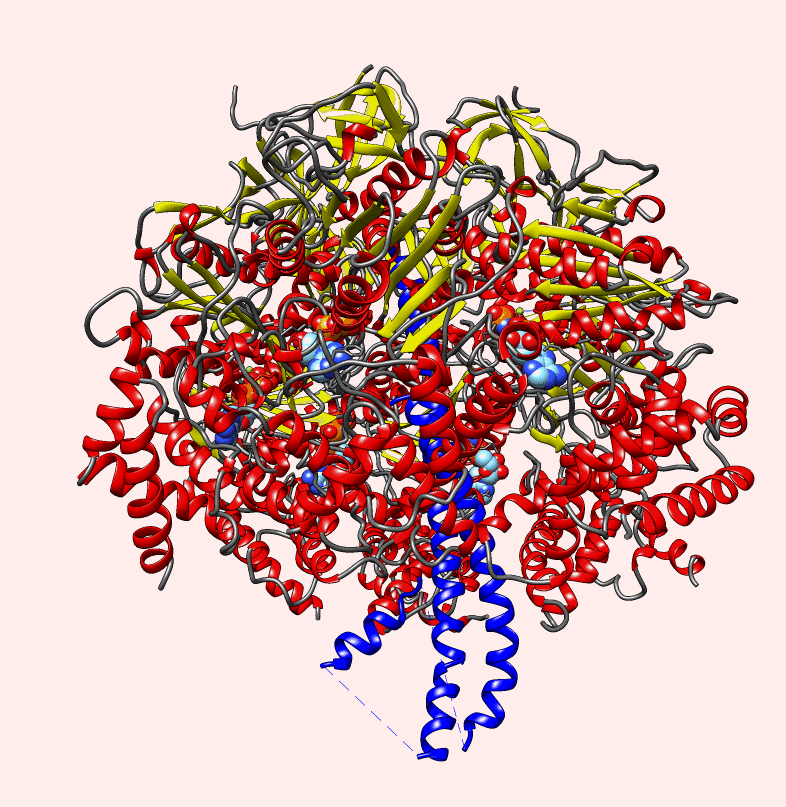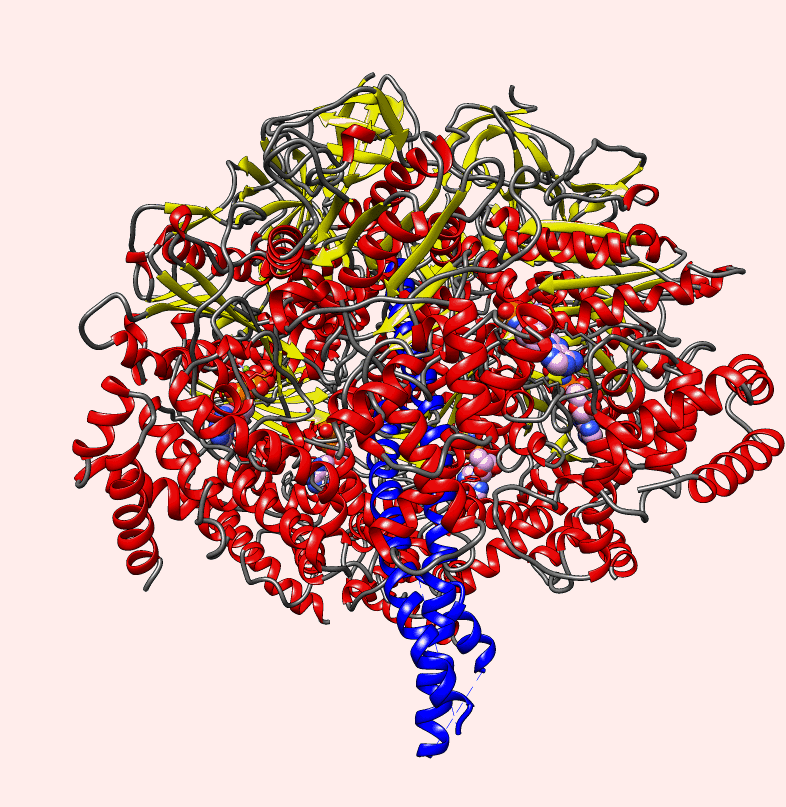
https://m.facebook.com/thebiowayonline/videos/atp-synthase-the-amazing-molecular-motor-giving-energy-to-the-cellatp-synthase-c/5191724420917868/?locale=ms_MY



https://fizjoterapeuty.pl/fizjologia/lancuch-oddechowy.html

https://slawekp7.wordpress.com/2021/05/19/bakterie-na-baterie-sloneczne-bakteriorodopsyna-o-wyjatkowym-procesie-fotosyntezy/



Chcę poruszyć kwestię tego, dlaczego problem ewolucji białek jest tak wielką sprawą i czego dotyczy niedawny spór z Martinem Poenie. Doktor Poenie, biolog z Uniwersytetu w Teksasie, krytycznie ocenił nową książkę Stephena Meyera „Wątpliwość Darwina”, co doprowadziło do wymiany zdań w ENV pomiędzy Poenie, Dougiem Axe i Jonathanem M. Debata na temat DDsmall.jpeg Jak wyjaśnił Steve Meyer w swojej książce, problem polega na tym, że liczba możliwych sekwencji białek, które mogłyby istnieć, jest bardzo duża i zajmuje bardzo dużą potencjalną przestrzeń sekwencji, ale liczba białek, które rzeczywiście istnieją, jest znacznie mniejsza i są one szeroko rozproszone w przestrzeni sekwencji (być może – w rzeczywistości jest to jedna z kwestii będących przedmiotem dyskusji).

Potencjalna przestrzeń jest tak duża, że czysto losowe poszukiwanie rzadkich białek funkcjonalnych zakończyłoby się spektakularnym niepowodzeniem. Zatem jeśli sekwencje funkcjonalne nie są łatwe do znalezienia (bardzo powszechne) i/lub nie są skupione razem (łatwo dostępne z jednej wyspy funkcjonalnej na drugą - brak ciągłości filogenetycznej), wyjaśnienie obecnej różnorodności białek bez projektu jest niemożliwe.
Nasi rozmówcy doskonale zdają sobie sprawę z problemu. Aby rozwiązać ten problem, niektórzy proponują, że pierwsze białka składały się z zaledwie kilku rodzajów aminokwasów. Albo że pierwsze białka były bardzo małe lub bardzo niespecyficzne („rozwiązłe” to słowo używane w tym kontekście w literaturze). To nieco zawęża skalę problemu.

Inni lubią sugerować, że po natknięciu się w jakiś sposób na jedno lub kilka udanych fałd, ewolucja była w stanie ruszyć naprzód poprzez kombinację duplikacji genów i kooptacji duplikatów do nowych funkcji lub poprzez rekombinację istniejących białek w nowe formy funkcjonalne.
Obecnie pojawia się także sugestia, że czasami można wygenerować całkowicie nowe białka w wyniku losowego wstawienia ruchomych elementów genetycznych do niekodującego DNA, chociaż jeszcze kilka lat temu uważano to za bardzo mało prawdopodobne.
Problem z tymi scenariuszami polega na tym, że wymagają one, aby białka były wyjątkowo tolerancyjne na rearanżacje i insercje sekwencji lub niezwykle łatwe do przejścia do nowych funkcji lub znacząco różniły się na początku życia od tego, czym są obecnie — dużymi, złożonymi makrocząsteczkami dostosowanymi do określone funkcje. Biorąc pod uwagę, że nikt nie wie, w jaki sposób garść niespecyficznych białek może przeprowadzić chemię życia, większość biologów ewolucyjnych opowiada się za wyjaśnieniami związanymi zliutacją zduplikowanych białek do nowych funkcji poprzez mutację punktową lub rearanżację lub utworzeniem de novo nowych genów kodujących białka z wcześniej niekodującego DNA.
https://slawekp7.wordpress.com/2021/08/05/pseudogeny-pseudo-funkcjonalne-czy-kluczowe-regulatory-w-zdrowiu-i-chorobie/
Tutaj robi się ciekawie. Jeśli przeanalizujesz przedstawione tutaj argumenty, wydaje się, że zaprzeczają one same sobie: 1. Białka można rekrutować do nowych funkcji, ale tylko jeśli zaczniesz od właściwej formy przodków.
Dzieje się tak, ponieważ do nadania białku kształtu i aktywności katalitycznej potrzeba wielu interakcji chemicznych; białka, które zbytnio różnią się sekwencją, mogą mieć zupełnie różne sieci interakcji, nawet jeśli mają ten sam kształt.
https://slawekp7.wordpress.com/2021/05/22/1wyrafinowane-dopasowania-komplementarne-w-biologii-i-nieuzyteczny-zlom-w-kontekscie-krytyki-pseudonaukowej-opowiesci-o-procesie-duplikacji-genow-i-powstawaniu-z-dodatkowych-kopii-to-znaczy-odpado/



Oznacza to, że może nie istnieć etapowa ścieżka konwersji jednego na drugi. Białka to delikatna sprawa. 2. Wprowadzenie kilku mutacji może tak zakłócić działanie enzymu, że jego delikatna aktywność katalityczna zostanie zniszczona, co uniemożliwi rekrutację enzymów do nowych funkcji, które nie są już bardzo podobne w sekwencji i/lub mają już pewien poziom funkcji. Powtórzę jeszcze raz: białka to delikatna sprawa.
https://slawekp7.wordpress.com/2021/08/21/spor-o-nieredukowalna-zlozonosc-kaskady-krzepniecia-krwi/
https://www.mp.pl/pacjent/hematologia/choroby/170465,hemofilia
https://www.medicover.pl/o-zdrowiu/anemia-sierpowata-objawy-i-leczenie-anemii-sierpowatej,75,n,192
LUB 3. Białka są wytrzymałe i można je łatwo ulepszyć poprzez ich rekombinację. W ten sposób można za jednym zamachem wytworzyć nowe kombinacje mutacji, omijając potencjalne kombinacje niefunkcjonalne. (Zignoruję fakt, że tego rodzaju rekombinacja działa tylko w organizmach diploidalnych, co pomija bakterie, Archaea i wszystkie najstarsze enzymy). 4. Możesz stworzyć nowy funkcjonalny gen poprzez wstawienie całych kawałków DNA do wcześniejszego niekodującego DNA, które ślepym trafem, a nie projektem, zostaje transkrybowane i tłumaczone na nowe funkcjonalne białko (coś, z czego organizm faktycznie korzysta).
https://slawekp7.wordpress.com/2021/06/05/nielosowe-mutacje-w-goracych-miejscach-mutacyjnych-mechanizmy-epigenetyczne-ewolucja-w-super-tempie-o-nowej-syntezie-ewolucyjnej/
Więc który to jest? Trudne czy łatwe? Pamiętaj, że aby ewolucja zadziałała, białka muszą być wyjątkowo tolerancyjne na rearanżacje sekwencji lub niezwykle łatwe do przejścia do nowych funkcji poprzez podstawienia aminokwasów, lub też sekwencje funkcjonalne muszą być dość powszechne. Wydaje się, że punkty 1 i 2 mówią, że ewolucję białek trudno wyjaśnić. Zgadzamy się. Gdyby przeniesienie białek do nowych funkcji było łatwe, wówczas powinno być możliwe coś w rodzaju przejścia między kbl i bioF (opublikowane tutaj).


https://slawekp7.wordpress.com/2021/05/22/1wyrafinowane-dopasowania-komplementarne-w-biologii-i-nieuzyteczny-zlom-w-kontekscie-krytyki-pseudonaukowej-opowiesci-o-procesie-duplikacji-genow-i-powstawaniu-z-dodatkowych-kopii-to-znaczy-odpado/



Jednak twierdzenie, że powodem naszej porażki było to, że nie zaczęliśmy od właściwej formy przodków, czyni historię życia jedną długą opatrznościową podróżą lub efektem niewiarygodnie szczęśliwej serii wypadków.
Artykuł Romero i Arnolda, który Poenie cytuje na poparcie twierdzenia nr 3, opiera się na eksperymentach, które nie mają nic wspólnego z problemem ewolucji darwinowskiej, a wszystko, co ma związek z inżynierią genetyczną. Naukowcy starali się zoptymalizować już istniejące enzymy poprzez rekombinację członków rodziny o tej samej strukturze i funkcji, ale różnych sekwencjach aminokwasów.
Aby zapewnić największe prawdopodobieństwo powodzenia, eksperymentatorzy zastosowali algorytm o nazwie SCHEMA, aby dokładnie wybrać punkty przerwania rekombinacji w pozycjach, które najprawdopodobniej pozwolą zminimalizować zakłócenia łańcuchów bocznych. Zatem ten eksperyment nie mówi nic o możliwościach losowej rekombinacji ani o jej zdolności do generowania nowej funkcji. W rzeczywistości wyraźnie stwierdzają, że w porównaniu z tym losowa rekombinacja wypada fatalnie.

Twierdzenie nr 4 opiera się na fakcie, że nowe sekwencje kodujące białka (omówione tutaj geny sieroce - pseudogeny) wydają się istnieć w naszych własnych genomach i gdzie indziej. Ale żeby podkreślić to, co powinno być oczywiste: fakt, że coś istnieje, nie wyjaśnia, w jaki sposób to powstało (czym innym jest funkcja czym innym geneza funkcji, czy mechanizm powstawania pseudogenów).
Jeśli nie zostanie wykazane, że wstawienie elementów do losowej, niekodującej sekwencji w sposób niekierowany rzeczywiście powoduje powstanie białek funkcjonalnych, wtedy możemy o tym rozmawiać, ile chcemy, ale wciąż nie wiemy, jak się tam dostały.
Wreszcie Doug Axe i inni mieli coś do powiedzenia na temat rzadkości występowania funkcjonalnych fałd. W jego artykule z 2004 roku zatytułowanym „Estimating the Prevalence of Protein Sequences Adopting Functional Enzyme Folds” podano szokująco małą liczbę. Z streszczenia: Zaczynając od słabo funkcjonalnej sekwencji niosącej [wzorzec wiązań hydropatycznych wzdłuż łańcuchów tworzących fałd domeny beta-laktamazy], skupiska dziesięciu łańcuchów bocznych w fałdzie są losowo zastępowane… i testowane pod kątem działania. Częstość występowania funkcji niskiego poziomu w czterech takich eksperymentach wskazuje, że mniej więcej jedna na 1064 sekwencji zgodnych z sygnaturą [mających te same ograniczenia hydropatyczne] tworzy domenę roboczą. Liczba ta opiera się na eksperymentach z prawdziwymi enzymami, a nie na makietach in silico. Więc który to jest? Z powyższego wynika, że białka nie tolerują rearanżacji sekwencji lub łatwo je zmienić na nowe funkcje poprzez podstawienia aminokwasów, a sekwencje funkcjonalne są dość rzadkie. Wydaje się, że niekierowana ewolucja białek jest trudna, bardzo trudna.”

Ciemna strona zmutowanego rybosomu – choroby związane z powstawaniem i funkcją rybosomów
https://www.researchgate.net/publication/307639510_Ciemna_strona_rybosomu_-_choroby_zwiazane_z_powstawaniem_i_funkcja_rybosomow
"Biogeneza rybosomu i jego funkcje w biosyntezie białek są skomplikowanymi, wysokoenergetycznymi procesami, do których działania potrzebnych jest wiele czynników wspomagających. Samo powstawanie rybosomów wymaga skoordynowanego współdziałania enzymów, białek opiekuńczych, regulatorów transkrypcji, które dbają o to, żeby rybosomalny RNA został poprawnie złożony z rybosomalnymi białkami.
Ponadto, każdy etap biosyntezy białka jest kontrolowany i wspomagany przez setki czynników, których dużej części pewnie jeszcze nie znamy. W każdym genie, który koduje taki czynnik czy też element struktury rybosomu (białka, rRNA), może powstać mutacja. Każde białko i RNA budujące rybosom, jak i białka odpowiedzialne za biogenezę rybosomu są kluczowe dla prawidłowego funkcjonowania organizmu i każdy ich defekt doprowadza do zaburzeń funkcjonowania komórki, a w konsekwencji do choroby lub nawet do śmierci. Choroby, u których podłoża leżą zaburzenia powstawania i działania rybosomu nazywa się rybosomopatiami, a najbardziej poznaną z nich jest niedokrwistość Blackfana – Diamonda, której molekularne podłoże opisano już w 1999 roku .
Zaskakująca ilość chorób powiązanych z biogenezą i funkcją rybosomów skłania naukowców do ciągłego poszukiwania i lepszego poznawania przyczyn powstawania rybosomopatii. Pomimo wielu lat badań nadal wiele tajemnic rybosomu zostaje nieodkrytych. Poznanie dokładnych mechanizmów biosyntezy białka jak i powstawania rybosomów jest zatem kluczem do głębszego poznania rybosomopatii jak i odkrycia możliwości ich leczenia. Celem niniejszej pracy jest zebranie i usystematyzowanie wiedzy na temat rybosomopatii, czyli chorób związanych z powstawaniem i funkcjonowaniem rybosomów."
https://www.salon24.pl/u/slawekp7/1328264,wyprawa-do-wnetrza-zywej-komorki-znakomity-film

„WYJAŚNIENIA” NEODARWINISTÓW. TAKIE SOBIE BAJECZKI


https://www.salon24.pl/u/slawekp7/1318584,czy-wiciowy-silnik-bakteryjny-mogl-wyewoluowac-na-drodze-kooptacji-z-t3ss


Biochemik profesor Michael Behe i nieredukowalna złożoność w biologii przed sądem!
https://slawekp7.wordpress.com/2021/06/05/biochemik-profesor-michael-behe-i-nieredukowalna-zlozonosc-w-biologii-przed-sadem/
https://slawekp7.wordpress.com/2021/02/12/gggggggo/

https://www.salon24.pl/u/slawekp7/1318584,czy-wiciowy-silnik-bakteryjny-mogl-wyewoluowac-na-drodze-kooptacji-z-t3ss


https://youtube.com/shorts/DL5aix31m8U?si=KJ96GOfBV2qTscyM

https://slawekp7.wordpress.com/2021/08/09/abiogeneza-najpierw-rna-najpierw-metabolizm-czy-najpierw-bialka/










https://en.wikipedia.org/wiki/Epistasis
Cytat:
Epistaza w genomach organizmów występuje w wyniku interakcji między genami. Ta interakcja może być bezpośrednia, jeśli geny kodują białka, które na przykład są oddzielnymi składnikami wieloskładnikowego kompleksu (takie jak rybosom [wić bakteryjna, syntaza ATP..] ), wzajemnie hamują własną aktywność [sprzężenia dodatnie i ujemne], lub jeśli białko kodowane przez jeden gen modyfikuje drugi gen (np. przez fosforylację, albo niezbędną obróbkę potranskrypcyjną, potranslacyjną: np modyfikowanie białek za pomocą proteaz [odcinanie sekwencji adresowych, żeby odsłonić sortujące], czy chaperonów ). Alternatywnie taka interakcja może być pośrednia, w których geny kodują komponenty szlaku metabolicznym, lub sieci szlaku rozwojowego , szlaku przekazywania sygnałów [transdukcji sygnału], lub kodujące czynniki transkrypcyjne, regulujące ekspresje danego genu w sieci [kolejność, czas wyrażania, co by się stało, gdyby geny kodujące białka rybosomowe nie ulegały precyzyjnej regulacji?]. Na przykład gen kodujący enzym, który syntetyzuje penicylinę, jest bezużyteczny dla grzyba bez enzymów, które syntetyzują niezbędne prekursory w szlaku metabolicznym. […..] Wysoki poziom epistazy jest zwykle uważany za czynnik ograniczający ewolucję, a ulepszenia wysoce epistatycznej cechy są uważane za mające mniejszą zdolność ewolucji . Dzieje się tak, ponieważ na jakimkolwiek podłożu genetycznym bardzo niewiele mutacji będzie korzystnych, chociaż może zajść potrzeba wystąpienia wielu mutacji, aby ostatecznie poprawić cechę.
https://www.salon24.pl/u/slawekp7/1324056,czym-sa-hipoteza-zalozenie-dowod-i-wyjasnienie
https://slawekp7.wordpress.com/2021/05/22/1wyrafinowane-dopasowania-komplementarne-w-biologii-i-nieuzyteczny-zlom-w-kontekscie-krytyki-pseudonaukowej-opowiesci-o-procesie-duplikacji-genow-i-powstawaniu-z-dodatkowych-kopii-to-znaczy-odpado/


POKREWNA TEMATYKA

https://slawekp7.wordpress.com/2019/03/19/helikazy-dna-u-bakterii-archeonow-i-eukariotow-sa-niehomologiczne/
https://www.salon24.pl/u/slawekp7/1318689,wybitny-biolog-profesor-stanislaw-mariusz-karpinski-o-ewolucji-chemicznej-abiogenezie-i-ewolucji-biologicznej
https://www.salon24.pl/u/slawekp7/1298661,czy-mozna-stworzyc-drzewo-obrazujace-przebieg-ewolucji-chemicznej
https://www.salon24.pl/u/slawekp7/1318689,wybitny-biolog-profesor-stanislaw-mariusz-karpinski-o-ewolucji-chemicznej-abiogenezie-i-ewolucji-biologicznej
https://www.salon24.pl/u/slawekp7/1318584,czy-wiciowy-silnik-bakteryjny-mogl-wyewoluowac-na-drodze-kooptacji-z-t3ss
https://www.salon24.pl/u/slawekp7/1318613,samolubny-gen-prof-richarda-dawkinsa-czy-samolubne-geny-prof-pawla-golika
https://www.salon24.pl/u/slawekp7/1320911,trafilem-na-rewelacyjny-artykul-rewolucja-w-pogladach-na-temat-lokomocji-i-taksonomii-australopitekow
https://www.salon24.pl/u/slawekp7/1324056,czym-sa-hipoteza-zalozenie-dowod-i-wyjasnienie







Michael Denton and Craig Marshall, Laws of form revisited, Nature 2001, vol. 410, s. 417.
— filed under: Ewolucjonistyczna krytyka darwinizmu
W krótkim tekście Michaela Dentona i Craiga Marshalla opublikowanym w renomowanym czasopiśmie Nature znaleźć można pewne idee "programu generującego ewolucję". Autorzy przypomnieli, że przed Darwinem większość biologów przyjmowała platoński model przyrody, według którego świat ożywiony składał się ze skończonego zbioru niezmiennych form naturalnych. Zdaniem autorów nie ma wątpliwości, że tak jest w świecie nieożywionym. Wystarczy przyjrzeć się atomom czy kryształom, by ujrzeć, że ich formy są ukształtowane przez zbiór praw fizycznych czyli pewnego rodzaju reguł konstrukcyjnych. Biologowie przeddarwinowscy poszukiwali zbioru praw fizycznych generujących formy biologiczne. Prawa te nazywali prawami formy.
Dla większości biologów tego typu rozważania są anachroniczne, ale najnowsze odkrycia w chemii białek sugerują, że przynajmniej jeden zbiór form biologicznych — elementarne fałdy białek — jest zdeterminowany przez prawa fizyczne podobne do tych, które określają kształt kryształów i budowę atomów.
Fałdy białek, podstawowe jednostki, z których białka są zbudowane, to w pewien sposób załamane łańcuchy od 80 do 200 aminokwasów. Niektóre białka składają się z pojedynczej fałdy, ale większość ma ich dwie lub trzy. Już w latach 1970-tych stało się jasne, że fałdy można sklasyfikować, że istnieje skończona liczba odrębnych rodzin strukturalnych, składających się z wielu ściśle powiązanych form. Fakt ten nasuwa myśl, że fałdy te mogą być naturalnymi formami w przeddarwinowskim, platońskim sensie.
Dalsze badania sugerują, że dopuszczalnych form fałd jest niewielka ilość. Niektóre oszacowania mówią o 4 tysiącach, inne o tysiącu lub nawet o pięciuset. Ponieważ jest to tylko niewielki ułamek wszystkich możliwych przestrzennych struktur polipeptydowych, wzmacnia to — zdaniem Dentona i Marshalla — podejrzenie, że fałdy, podobnie jak atomy w fizyce — reprezentują skończonych zbiór wbudowanych form naturalnych.
Autorzy wskazali także na trwałość fałd w obliczu rozmaitego rodzaju krótkotrwałych deformacji wywołanych molekularnymi turbulencjami komórki oraz długotrwałych ewolucyjnych zmian sekwencji aminokwasów. Ponadto tę samą fałdę można otrzymać przy pomocy różnych, wyraźnie niepowiązanych sekwencji aminokwasów, a także w wielu przypadkach ta sama fałda przystosowana jest do pełnienia bardzo odmiennych funkcji biochemicznych. Wszystko to zdaniem autorów zgodne jest z tym, czego należałoby oczekiwać, gdyby fałdy białek były realizacją form naturalnych.
W końcu swego tekstu obaj autorzy wyrazili przypuszczenie, że być może istnieją też formy naturalne na wyższych piętrach architektoniki życia. Poznać je będzie można po tym, że będą to struktury stabilne i faworyzowane energetycznie.
Michael Denton opublikował swego czasu głośną książkę Evolution: A Theory in Crisis. Kreacjoniści czerpali z niej pełnymi garściami argumenty przemawiające przeciwko teorii ewolucji. Istniała nadzieja, że Denton z czasem będzie "ewoluował" w kierunku kreacjonizmu. Nadzieja ta się nie spełniła, ale Denton pozostał nadal nieortodoksyjnym ewolucjonistą, krytycznie nastawionym wobec biologii głównego nurtu.
Mieczysław Pajewski
Przypisy
Źródło: Na Początku... styczeń-marzec 2001, nr 1-3 (138-140), s. 88-89.

https://slawekp7.wordpress.com/2021/06/05/nielosowe-mutacje-w-goracych-miejscach-mutacyjnych-mechanizmy-epigenetyczne-ewolucja-w-super-tempie-o-nowej-syntezie-ewolucyjnej/

https://slawekp7.wordpress.com/2021/02/17/w-czym-tkwi-problem-takich-naukowcow-jak-profesor-pawel-golik-czy-mozna-pogodzic-epigenetyke-i-inne-nielosowe-mechanizmy-adaptacyjne-z-neodarwinizmem/

https://slawekp7.wordpress.com/2021/02/17/w-czym-tkwi-problem-takich-naukowcow-jak-profesor-pawel-golik-czy-mozna-pogodzic-epigenetyke-i-inne-nielosowe-mechanizmy-adaptacyjne-z-neodarwinizmem/



https://tiny.pl/c5vr8
Biologiczne mechanizmy molekularne. Eksperymentalne poparcie dla wniosku o projekcie
Michael Behe
„(.....) Białka

Zastanówmy się najpierw nad najbardziej podstawowymi narzędziami komórki. Biochemia wykazała, że mechanizmami w żywej tkance, które budują struktury i przeprowadzają reakcje chemiczne konieczne dla życia, są cząsteczki zwane białkami. Podstawowa struktura białek jest dość prosta (patrz rys.): ukształtowane są przez nieciągłe podjednostki, zwane aminokwasami, które są sczepione w postaci łańcucha. Każdy z dwudziestu odmiennych rodzajów aminokwasów ma odmienny kształt i odmienne własności chemiczne, a typowy łańcuch białkowy składa się z około 50 do około 1 000 aminokwasowych ogniw.Ale białko w komórce nie pływa jak wiotki łańcuch (patrz rys. na lewo); raczej tworzy ono bardzo precyzyjną strukturę, która może być bardzo różna dla różnych typów białek; to właśnie struktura tak złożonego białka dokładnie determinuje funkcję, jaką ono pełni. A ponieważ sposób ułożenia i pofałdowanie białka zdeterminowany jest przez sekwencję aminokwasów, to sekwencja ta także determinuje funkcję białka. Nowoczesna biochemia zaczęła istnieć w przybliżeniu czterdzieści lat temu, kiedy nauka rozwinęła się do tego stopnia, że mogła określić dokładne struktury tych podstawowych cząsteczkowych składników układów biologicznych. Kiedy J.C. Kendrew ze współpracownikami określił pierwszą strukturę białka dla mioglobiny, białka występującego w mięśniu, to najbardziej uderzającą cechą dla niego była złożoność i brak symetrii tej cząsteczki. A jego kolega, laureat nagrody Nobla, Max Perutz, wydawał się znajdować w najwyższej rozpaczy, gdy zauważył:
„Czy to możliwe, by poszukiwanie ostatecznej prawdy rzeczywiście doprowadziło do ujawnienia tak obrzydliwego i podobnego do trzewi obiektu?”
(Mioglobina przypomina jelita.) Zanim ujawniono strukturę mioglobiny, większość uczonych oczekiwała, że ta białkowa czarna skrzynka zawiera proste, regularne cząsteczki, podobne do kryształków soli, i złożoność, jaką ujrzeli, zaskoczyła ich. Chociaż biochemicy przyzwyczaili się już do kształtu białek i stopniowo polubili je, złożoność tych struktur pozostaje.
Rozpoznanie struktur białek spowodowało, że uczeni zaczęli się zastanawiać, jakie jest prawdopodobieństwo, by jakaś sekwencja aminokwasów mogła uformować złożoną postać konkretnego zwartego, funkcjonalnego białka. Od dawna wiadomo, że chociaż różne klasy białek mają odmienne sekwencje aminokwasów i różne kształty, że analogiczne białka z różnych gatunków, na przykład hemoglobina człowieka i hemoglobina konia, różnią się swoimi sekwencjami aminokwasów, to jednak formują podobne struktury. Ale wiadomo także, że zmiany niektórych aminokwasów niszczą strukturę białka. Jakie są więc granice tolerancji dla zmian aminokwasów? Jakie jest prawdopodobieństwo znalezienia jakiegoś konkretnego białka w nieukierunkowanym badaniu?
W ciągu ostatnich kilku lat odpowiedzi na te pytania nadeszły z laboratorium Roberta Sauera na Wydziale Biologii Massachusetts Institute of Technology. [8] W laboratorium Sauera pobierano geny dla kilku białek wirusowych (patrz rys. powyzej), systematycznie rozdrabniano je na części i wstawiano odmienne fragmenty z powrotem do genów. Te zmienione geny umieszczano wówczas ponownie w bakteriach, które odczytywały kod DNA i produkowały z nich łańcuchy aminokwasów. Okazało się, że bakterie te szybko niszczyły białka, które nie były odpowiednio przestrzennie ułożone. Grupa Sauera poszukiwała więc takich odmienionych białek, które nie zostały zniszczone. Określając ich sekwencje, mogli powiedzieć, które aminokwasy w danym miejscu zgodne były z tworzeniem złożonego przestrzennie, funkcjonalnego białka podobnego do białka rodzicielskiego.

Grupa Sauera zauważyła, że w niektórych miejscach białka tolerowana była duża rozmaitość aminokwasów (patrz rys. powyżej). W niektórych miejscach mogło wystąpić do 15 spośród 20 aminokwasów i nadal dawać funkcjonalne, przestrzennie ustrukturowane białko. Jednak w innych miejscach w sekwencji aminokwasów tolerowane mogło być bardzo niewielkie zróżnicowanie. Wiele miejsc mogło przyjąć tylko 3 lub 4 odmienne aminokwasy. Inne miejsca miały absolutny wymóg na tylko konkretny aminokwas; znaczy to, że jeśli - powiedzmy - P nie występuje w miejscu 78 danego białka, to białko nie przybierze charakterystycznego przestrzennego kształtu, pomimo tego, że reszta sekwencji jest zbliżona do białka naturalnego.
Z faktycznych wyników eksperymentalnych grupy Sauera, jak to pokazuje rysunek, można łatwo obliczyć, że prawdopodobieństwo znalezienia złożonego białka wynosi około 1/1065 [9] Liczba ta jest niemal identyczna z wynikami otrzymanymi wcześniej przy pomocy obliczeń teoretycznych i to podobieństwo wyników wielce wzmacnia nasze zaufanie, że otrzymano poprawny wynik. Aby wyrobić sobie opinię na temat tej fantastycznie małej liczby, wyobraźmy sobie, że ktoś schował ziarnko piasku, oznaczone maleńkim "X"-em, gdzieś na pustyni Sahara. Po kilkuletnim włóczeniu się na ślepo po tej pustyni, schylasz się i znajdujesz to maleńkie "X". Żywiąc podejrzenia, dajesz to ziarenko piasku komuś, by je ponownie schował, znowu błąkasz się ślepo po pustyni, schylasz się i jeszcze raz podnosisz to samo ziarenko oznaczone "X"-em. Trzeci raz powtarzasz swoje działania i trzeci raz znajdujesz oznaczone ziarenko. Prawdopodobieństwo znalezienia tego oznaczonego ziarenka piasku na pustyni Sahara trzy razy pod rząd jest mniej więcej takie samo, jak znalezienia jednej nowej funkcjonalnej struktury białka, jednego z podstawowych narzędzi komórki. Większość ludzi uzna raczej, że cała sprawa została z góry ukartowana, niż że jest to wynik szczęśliwego nałożenia się przypadków.
Wielki postęp w biochemii w ciągu ostatnich czterdziestu lat wykazał, że podstawowe narzędzia życia, białka, są nadzwyczaj złożone. Perutz i Kendrew byli zaskoczeni, kiedy - oczekując prostoty - natknęli się po raz pierwszy na złożoność mioglobiny. Chociaż z upływem czasu nowość struktury mioglobiny utraciła na ostrości, doznajemy podobnego zaskoczenia, kiedy nowe eksperymenty, podobne do eksperymentów wykonywanych przez grupę Sauera, odnawiają nasze rozumienie złożoności funkcjonalnych białek, która odzwierciedlona jest w bardzo małym prawdopodobieństwie ich wystąpienia.”

https://slawekp7.wordpress.com/2013/08/02/mit-hipotezy-doboru-krewniaczego-dobor-krewniaczy-a-nieredukowalna-zlozonosc/





https://www.salon24.pl/u/adaptacjeslawekp/1135549,skad-sie-wzial-transport-pecherzykowy-w-chloroplastach-na-bezdrozach-hipotezy-endosymbiozy


Zobacz galerię zdjęć:
Nauka

